מחלות נוירודגנרטיביות ובהן אלצהיימר, ALS, הנטינגטון ופרקינסון נובעות מתמותת נוירונים, תאי עצב. תהליך זה מתרחש בדרך כלל כתוצאה מאגרגציה – הידבקות של חלבונים זה לזה באופן היוצר משקע רעיל הממית את התא.
אף שעדיין קיימת מחלוקת לגבי הקשר הסיבתי בין התופעות, אגרגציה (הצטברות), של חלבונים נחשבת כיום לסימן ההיכר העיקרי של אותן מחלות. עם זאת, המנגנונים המדויקים של תהליך ההצטברות עדיין אינם ברורים די הצורך, מה שמעכב את פיתוחם של טיפולים יעילים במחלות אלה.
במחקר שהתפרסם ב-Nature Communications מציגות חוקרות הטכניון ממצאים חדשים הנוגעים להיווצרותם של אותם משקעי חלבון. את המחקר הובילו פרופ’ רעות שלגי (בתמונה, צילום דוברות הטכניון) והדוקטורנטיות כנרת רוזלס ואמל יוניס מהפקולטה לרפואה ע”ש רפפורט.
חלבונים הם אבני הבניין של התא, והם האחראים למרבית הפעולות המתרחשות בגוף. החלבונים נוצרים מחומצות אמינו בתהליך שמכתיב הקוד הגנטי, ושלב קריטי בתהליך זה הוא קיפולם קיפול שמקנה להם מבנה תלת-ממדי החיוני לתפקודם התקין. תהליך הקיפול מבוקר על ידי חלבונים אחרים הקרויים שפרונים (Chaperones), ובהם התמקד המחקר הנוכחי.
חוקרות הטכניון, שהתמקדו במחלת ALS ובמחלת הנטינגטון, גילו כי פעילותם של השפרונים משפיעה באופנים שונים בשתי המחלות. לדברי פרופ’ שלגי, “מה שגילינו במחקר הוא שאפילו אותו שפרון, בווריאציות שונות שלו, עשוי להוביל לתוצאות הפוכות בשתי המחלות.”
וריאציות של שפרונים נקראות איזופורמים. חוקרות הטכניון גילו כי במחלת ALS, שפרון מסויים עשוי לפעול בדרכים שונות אם זהו איזופורם “רגיל” הוא מצליח למנוע אגרגציה של החלבון הגורם למחלה (חלבוני FUS), דבר שיעכב את הפגיעה בנוירונים; אולם אם הוא איזופורם קצר הוא לא ישפיע כך.
בהנטינגטון, לעומת זאת, ההשפעה הפוכה: דווקא האיזופורמים הקצרים ימנעו את האגרגציה של החלבון הגורם למחלה (חלבון HTT-polyQ), ואילו האיזופורמים ה”רגילים” יאיצו את ההצטברות, דבר שעלול להוביל להחמרת המחלה.
בניסויים בתאים ובנוירונים גילו החוקרות כי ביטוי מוגבר של האיזופורם הנכון מאפשר לצמצם בשיעור דרמטי (עד 80%) את האגרגציה של החלבונים הגורמים למחלה בתא. “למעשה, השפרונים הם מרכיב חיוני בהגנה על המוח בפני ניוון. חלק מהם נכנסים לפעולה בתגובה לעקות שונות כגון חום, וזאת כדי להגן על החלבונים; אבל במקרה של מחלות נוירודגנרטיביות, אלה אינם השפרונים המתאימים להילחם בתהליך האגרגציה. הכלים הנכונים קיימים בארגז הכלים של התא, וכעת גילינו בדיוק באילו כלים נכון להשתמש במקרה של ALS הנגרמת על ידי החלבון FUS. לצערנו, התא אינו יודע באילו כלים בדיוק עליו להשתמש במקרים האלה, ולעתים שימוש בכלים הלא נכונים יוביל לתוצאה הרסנית. התקווה שלנו היא שעל סמך הממצאים הנוכחיים נוכל בעתיד לפתח שיטות להגברת הביטוי של השפרונים ה’נכונים’ בנוירונים, בהתאם למחלה הספציפית. כך תיסלל הדרך לטיפולים יעילים בסגנון ?רפואה מותאמת אישית? למחלות נוירודגנרטיביות הנחשבות כיום למחלות חשוכות מרפא.”
המחקר נערך בשיתוף פעולה עם מעבדת ברלין בפקולטה לרפואה ע”ש רפפורט בטכניון ונתמך על ידי הקרן הלאומית למדע, האיחוד האירופי (ERC), ומרכז פרינס למחלות נוירולוגיות של המוח.
למאמר המדעי ב- Nature Communications לחצו כאן
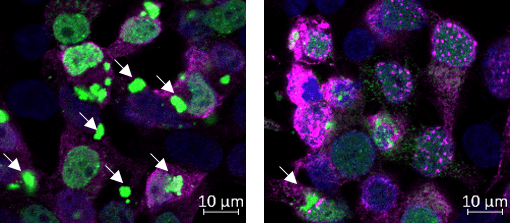
בצילום :
תאים המבטאים חלבוןFUSעם מוטציה הגורמת למחלתALS(מסומן בירוק). חלבון זה יוצר אגרגטים בתוך התאים (חיצים לבנים). כאשר מבטאים בנוסף את השפרוןDNAJB14(מסומן בוורוד, תמונה ימנית), התאים מייצרים הרבה פחות אגרגטים שלFUSמוטנטי.















השאירו תגובה
רוצה להצטרף לדיון?תרגישו חופשי לתרום!