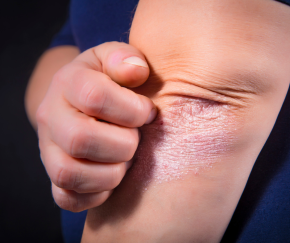
מנהל המזון והתרופות האמריקאי (Food and Drug Administration) הודיע על אישור הרחבת ההתוויה למתן הטיפול הפומי ב- Livmarliלהקלה על גרד משנית למחלת כבד בחולים בגילאי חמש שנים ומעלה, כך על-פי הודעה לתקשורת של חברת התרופות Mirum Pharmaceutical.
הסוכנות אישרה את התרופה לטיפול בגרד משנית למחלת Progressive Familial Intrahepatic Cholestasis, הפרעה גנטית העלולה להוביל למחלת כבד מתקדמת עד התפתחות כשל כבדי.
הטיפול ב- Livmarli כבר מאושר לטיפול בגרד משנית למחלת כבד גנטית אחרת, תסמונת אלג’יל (או Alagille Syndrome) ובחברת התרופות דיווחו כי Livmarli תושק עם זמינות מיידית לחולים מתאימים בארצות הברית באותה עלות כמו זו שאושרה לטיפול בחולים עם תסמונת אלג’יל.
האישור הנוכחי של מנהל המזון והתרופות האמריקאי להרחבת ההתוויה לטיפול ב- Livmarli מבוסס על מחקר שכלל 93 חולים עם אבחנה של Progressive Familial Intrahepatic Cholestasis, כולם היו בגילאי 1-17 שנים, כאשר מהנתונים עלה כי הטיפול התרופתי סייע בהקלה על חומרת הגרד של החולים.
חברת התרופות הגישה בקשה למנהל המזון והתרופות האמריקאי להרחבת השימוש בתכשיר Livmarli בריכוז גבוה יותר בחולים צעירים יותר עם מחלת הכבד הגנטית.
מתוך הודעת ה-FDA
















השאירו תגובה
רוצה להצטרף לדיון?תרגישו חופשי לתרום!