הודעת פלוריסטם
הניסוי הקליני נערך בהובלתו של פרופ’ רון רם, מנהל יחידת השתלות מח עצם במרכז הרפואי סוראסקי, בית החולים איכילוב
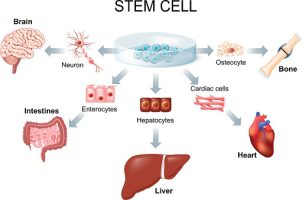
הקבוצה הראשונה של הניסוי הקליני כללה 6 חולים, שטופלו בתאי PLX הייחודיים של פלוריסטם, המופקים מתאי שלייה אנושיים. לאחר תקופת מעקב של 3 חודשים, הטיפול בתאי ה-PLX התגלה כבטיחותי ולא דווחו תופעות לוואי
4 מתוך 6 מטופלים דיווחו על שיפור בתסמינים
חיפה, 13 באוקטובר 2020 – Pluristem Therapeutics Inc (נאסד”ק: PSTI) (ת”א: PSTI), חברה מובילה ברפואה משקמת, המפתחת פלטפורמה מתקדמת לתרופות ביולוגיות, מעדכנת כי קיבלה את אישור ועדת הלסינקי לגיוס קבוצה שנייה של חולים לניסוי הקליני שלב I/II לטיפול במחלה הכרונית השתל מול המאכסן (“cGvHD”)
הניסוי הקליני בוחן את הטיפול באמצעות תאי PLX-PAD הייחודיים של החברה, המופקים מתאי שלייה אנושיים, במחלה הכרונית השתל מול המאכסן (“cGvHD”). הניסוי הקליני נערך בהובלתו של פרופ’ רון רם, מנהל יחידת השתלות מח עצם במרכז הרפואי סוראסקי, בית החולים איכילוב בישראל. פרופ’ רם וצוות המחקר שלו אמונים על תכנון וביצוע הניסוי הקליני בבית החולים איכילוב.
מחלת השתל מול המאכסן הינה תגובת נגד חיסונית חמורה, המופיעה אצל חולים שעברו השתלת תאי מח עצם, כאשר תאי הגזע של התורם מזהים את גופו של החולה (בו הושתלו התאים) כזר ותוקפים אותו. תקיפת תאי החולה על ידי תאי התורם הינה הגורם העיקרי לתחלואה ותמותה בקרב חולים מסוג זה. המחלה הכרונית השתל מול המאכסן מופיעה בדרך כלל כמאה ימים לאחר ההשתלה.
הקבוצה הראשונה של הניסוי הקליני כללה 6 חולים אשר טופלו בשתי זריקות הכוללות 150 מיליון תאים כל אחת, אשר ניתנו לחולים בהפרש של שבוע. לאחר תקופת מעקב של 3 חודשים, הטיפול בתאי PLX התגלה כבטיחותי ולא דווחו תופעות לוואי.
מבחינת יעילות הטיפול, 4 מתוך 6 מטופלים דיווחו על שיפור בתסמינים, שיפור כאמור בא לידי ביטוי בירידה בחומרת המחלה וכן בהפחתת מינון הסטרואידים הניתן לחלק מחולים.
בהתבסס על תוצאות אלו, החברה קיבלה אישור לגיוס 14 חולים נוספים לקבוצה השניה של הניסוי הקליני, אשר במסגרתו יינתן טיפול של 4 זריקות הכוללות 150 מיליון תאים כל אחת.
פרופ’ רון רם, מנהל יחידת השתלות מח עצם במרכז הרפואי סוראסקי, אמר בתגובה: “בניסוי הקליני טיפלנו ב- 6 חולי GvHD כרוניים שאינם מגיבים לסטרואידים, באמצעות תאי PLX-PAD. עד כה לא דווחו תופעות לוואי שליליות. חולים ב- GvHD אשר התגלו עם מחלות עור, שטופלו בעבר במגוון רחב של טיפולים ללא הצלחה, הראו תגובה יוצאת דופן. תגובות נצפו גם ביחס לפצעים חמורים בפה שמנעו מהחולים לאכול מזון מוצק. הטיפול הביא לשיפור משמעותי באיכות החיים של המטופלים ולהורדה במינונים של הסטרואידים”.
מר יקי ינאי, מנכ”ל ונשיא פלוריסטם: “פלוריסטם מחויבת לתרום לרווחתם ואיכות חייהם של מטופליה. מחלת השתל מול המאכסן היא אינדיקציה רפואית שבה אנו רואים צורך משמעותי בהגברת מהלך הטיפול הנוכחי, לאור המצב המסכן חיים בקרב חולים שעברו השתלת מוח עצם. התוצאות הראשוניות של קבוצה I של הניסוי הקליני, ונתונים פרה-קליניים קודמים, מצביעים על כך שתאי PLX-PAD עשויים לטפל בחולי cGvHD ולהקל על הסימפטומים. אנו שמחים מאוד לשתף פעולה עם פרופ’ רם והמרכז הרפואי סוראסקי, ואנו מייחסים חשיבות גבוהה לבחינת הטיפול באמצעות PLX-PAD באינדיקציה רפואית זו”.
מחלת שתל מול המאכסן (cGvHD)
מחלת השתל מול המאכסן כרונית נותרה סיבוך שכיח אשר עלול לסכן חיים לאחר השתלת תאי גזע המטופויטיים אלוגניים (HCT). השכיחות המצטברת של שנתיים של מחלת השתל מול המאכסן כרונית הדורשת טיפול מערכתי, היא כ-30% עד40%, על פי הקריריונים של National Institutes of Health. השתלות של תאי גזע המטופויטיים משמשת לטיפול בכשל במח עצם, הנובעת מטיפול במספר סוגי סרטן דם או מח עצם וכן בכשלים המטולוגיים אחרים, כגון אנמיה אפלסטית, שאינם קשורים לסרטן. התאים שנתרמו מזהים את גופו של החולה (המותרם) כזר ותוקפים אותו כתוצאה מכך. בעוד ש- GvHD מופיע בדרך כלל במאה הימים הראשונים לאחר ההשתלה, ומקומות ספציפים בגוף, GvHD כרוני יכול להופיע בכל עת (אפילו מספר שנים) לאחר ההשתלה, ועלול לתקוף חלקים רבים בגוף כגון: עור, פה, עיניים, כבד, מעיים, ריאות ומפרקים. הטיפול הקיים הינו באמצעות תרופות המדכאות את מערכת החיסון, הניתן על מנת לנסות למנוע cGvHD או לטפל בו. מאחר וטיפול זה מדכא את המערכת החיסונית לאורך זמן רב, המטופלים נמצאים בסיכון גבוה לזיהומים, והם נוטלים תרופות מרובות בכדי לנסות למזער את הסיכון בהופעת המחלה.
אודות פלוריסטם
פלוריסטם תרפיוטיקס הינה חברה ביו-רפואית המובילה ברפואה רגנרטיבית, המפתחת תרופות תאיות שמקורן בשליה. בעבר החברה דיווחה על נתוני ניסויים קליניים שביצעה במספר אינדיקציות בשימוש במוצריה הרשומים כפטנט, המבוססים על תאי PLX וכעת החברה מבצעת ניסויים קליניים מתקדמים במספר אינדקציות נוספות. ההערכה היא כי מוצרים המבוססים על תאי PLX מאפשרים שחרור של מגוון חלבונים טיפוליים המאפשרים טיפול בדלקות, איסכמיה (חוסר זרימת דם), טראומות שריר, הפרעות המטולוגיות ונזקי קרינה. גידול התאים מבוצע באמצעות טכנולוגיית תלת ממד ייחודית של החברה, המאפשרת טיפול שאינו מצריך התאמה גנטית למטופל. לחברה קניין רוחני חזק ורחב ,מתקני ייצור ומו”פ בעלי אישור GMP, קשרים אסטרטגיים עם מכוני מחקר מרכזיים וצוות ניהול מנוסה.
הודעה זו כוללת מידע צופה הפני עתיד כמשמעותו על פי חוקי ניירות הערך האמריקאים וכן על פי הוראות ה- Safe Harbor בחוק ה- U.S. Private Securities Litigation Reform Act משנת 1995. לפרטים אודות פסקת המידע צופה פני עתיד על הנוסח המחייב שלה, ראה ההודעה הרשמית באנגלית שפרסמה החברה והמופיעה באתר הבורסה.












השאירו תגובה
רוצה להצטרף לדיון?תרגישו חופשי לתרום!