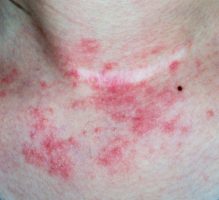
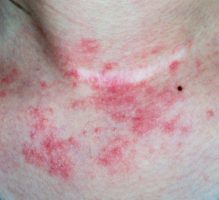
מנהל המזון והתרופות האמריקאי (Food and Drug Administration) הודיע על אישור Tralokinumab, נוגדן חד-שבטי הנקשר ל-Interleukin-13 (IL-13) ומונע קישור לקולטן, לטיפול באטופיק דרמטיטיס בדרגה בינונית-עד-חמורה.
המומחים מסבירים כ בארצות הברית יש כ-6.6 מיליון חולים עם אטופיק דרמטיטיס בדרגה בינונית-עד-חמורה. האישור הנוכחי של הטיפול התרופתי מספק אפשרות טיפול ביולוגי חדשה בחולים אלו ומדובר בצעד חשוב, העשוי לסייע למיליוני חולים הסובלים ממחלת העור.
אישור הטיפול מבוסס על תוצאות תכנית ECZTRA, הכוללת שלושה מחקרים בשלב 3 וקרוב ל-2,000 חולים. בשלושת המחקרים, שיפור מובהק סטטיסטית במדדי IGA (Investigator Global Assessment), ESAI (Eczema and Area Index) ו-Worst Daily Pruritis NRS דווחו בחולים שטופלו ב- Tralokinumab לעומת חולים בזרוע הפלסבו.
מהנתונים עלה כי Tralokinumab הדגים שיפור מובהק סטטיסטית בכל תוצאי הסיום העיקריים והמשניים, בהשוואה לפלסבו, בין אם ניתן עם או ללא טיפול מקומי בקורטיקוסטרואידים.הטיפול הוביל לשיפור משמעותי קלינית בחומרת הנגעים, גרד, איכות חיים ותוצאי סיום רבים אחרים.
הטיפול ניתן במזרק מוכן מראש במינון של 150 מ”ג/מ”ל ויהיה זמין למתן בזריקה תת-עורית. המינונים מתחילים ב-600 מ”ג כמינון ראשוני, לאחר מכן ניתן מינון של 300 מ”ג כל שבועיים. בחולים במשקל נמוך מ-100 ק”ג שהשיגו עור נקי או כמעט נקי לאחר 16 שבועות טיפול, ניתן לשקול מתן מנה של 300 מ”ג כל ארבעה שבועות.
לאחר התייצבות החולים והשגת עור נקי ניתן לתת פחות זריקות של התרופה, צעד אשר בהחלט נתפס כחיובי בעיניי החולים ואינו פוגע ביעילות הטיפול. באופן זה, חלק גדול מהחולים שומרים על תגובה קלינית ממושכת, אך עם מחצית מכמות הזריקות.
מתוך הודעת ה-FDA














השאירו תגובה
רוצה להצטרף לדיון?תרגישו חופשי לתרום!