הודעת רדהיל
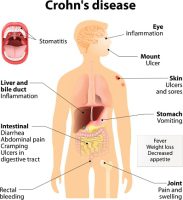
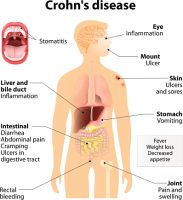
חברת הביו-פרמצבטיקה הישראלית, רדהיל ביופארמה (נאסד”ק/ת”א: RDHL), המתמקדת בתרופות אוראליות מסוג מולקולות קטנות, מוגנות פטנט, בשלבי פיתוח קליניים מתקדמים, לטיפול במחלות הקשורות לדרכי העיכול ובמחלות דלקתיות ובכלל זה סרטן, סיפקה היום עדכון אודות תכנית הפיתוח של תרופת RHB-104 לטיפול במחלת הקרוהן, שינויים מתוכננים בניסוי שלב III עם RHB-104 (ניסוי המכונה MAP US) ואבני-דרך צפויות.
ד”ר איירה קלפוס, MD, מנהל רפואי ברדהיל ביופארמה, אמר: “הגדלת מספר החולים בניסוי שלב III עם RHB-104 והוספת ניסוי תווית-פתוחה משקפים את העניין ההולך וגדל מהחוקרים הקליניים בניסוי, אשר רואים את התועלת הפוטנציאלית של RHB-104 ואת הערך שבהשתתפות בניסוי חשוב זה.” ד”ר קלפוס הוסיף: “אנו מצפים כי השינויים בתכנית הפיתוח לא ישפיעו באופן מהותי על לוחות הזמנים הצפויים וכי הוספת ניתוח הביניים ברבעון השני של 2017 לבחינת האפשרות להפסקה מוקדמת של הניסוי, במקרה של הצגת יעילות מובהקת, עשוי למעשה לקצר באופן משמעותי את הזמן להשלמת הניסוי.”
רדהיל הוסיפה לפרוטוקול הניסוי שלב III עם RHB-104 אופציה להפסקה מוקדמת של הניסוי בשל הצלחה, במקרה של הצגת יעילות מובהקת. בחינת האופציה להפסקה מוקדמת של הניסוי צפויה ברבעון השני של 2017 כחלק מניתוח ביניים שני של ועדת נתונים ובטיחות בלתי-תלויה (DSMB) אשר יכלול ניתוח של נתוני יעילות ובטיחות. ההוספה של האופציה להפסקה מוקדמת של הניסוי עשויה לאפשר קיצור, באופן ניכר, של הזמן הנדרש להשלמת הניסוי.
ניתוח ביניים של נתוני בטיחות על-ידי ועדת DSMB בניסוי שלב III עם RHB-104 יתקיים כמתוכנן ברבעון הרביעי של 2016.
RHB-104 הינה תרופה בעלת פוטנציאל פורץ-דרך לטיפול במחלת הקרוהן המיועדת לטיפול בגורם זיהומי משוער של המחלה, חיידק ה- Mycobacterium avium subspecies paratuberculosis (MAP).
במסגרת תכנית הפיתוח של רדהיל לבדיקה דיאגנוסטית נלווית לזיהוי של חיידק ה- MAP, זוהה בהצלחה DNA של חיידק ה- MAP בדגימות דם שנלקחו מחולי קרוהן. עבודת הפיתוח של הבדיקה הדיאגנוסטית נמשכת. רדהיל חתמה לאחרונה על הסכם שיתוף פעולה מחקרי עם
בית-הספר לרפואה של אוניברסיטת Baylor – הסכם שלישי מסוג זה, עם אוניברסיטה מובילה בארה”ב, לפיתוח של טכנולוגיה דיאגנוסטית לזיהוי חיידק ה- MAP.
על-מנת להגדיל את עוצמתו של הניסוי שלב III עם RHB-104, לספק הערכה מדויקת יותר להשפעה הטיפולית של RHB-104 ולהגביר אף יותר את הסיכויים להצלחת הניסוי, רדהיל מיישמת מספר שיפורים לפרוטוקול הניסוי ומציגה שינויים נוספים לתכנית הפיתוח הכוללת של תרופת RHB-104, ובכלל זה:
– מספר החולים אשר יגויסו לניסוי שלב III עם RHB-104 הוגדל מ- 270 ל- 410 חולים, על-מנת להרחיב את האיסוף של מידע קליני, בכלל זה מידע אנדוסקופי על החלמת רירית המעי, ולפצות על מקרים של הפסקה מוקדמת של הטיפול. הגדלת מספר החולים בניסוי נערכה בהתאם להערכות היסטוריות של עוצמה סטטיסטית ושיעורי נסיגת המחלה בניסויי שלב III שנערכו עם תרופות אשר אושרו לטיפול במחלת הקרוהן.
– עוצמה סטטיסטית של 90% נשמרה בניסוי וחישוב גודל המדגם שונה על-מנת להפחית את ההשפעה הניתנת לזיהוי מ- 21% ל- 15%, נתון המשקף באופן מדויק יותר מבחינה קלינית את ההשפעה הצפויה מהטיפול. בנוסף, לאור שינוי גודל המדגם ניתן יהיה להפיק הערכות מדויקות יותר של השפעת הטיפול. רדהיל לא מתכננת שינויים ביעד העיקרי של הניסוי, שהינו נסיגה של המחלה המוגדרת כמדד פעילות מחלה (CDAI) בשיעור נמוך
מ- 150 בשבוע ה- 26 של הטיפול.
– עם 219 חולים אשר כבר גויסו לניסוי שלב III עם RHB-104, מתוך סך כולל של 410 חולים, פגישה שנייה של ועדת DSMB צפויה ברבעון השני של 2017, כאשר 205 החולים הראשונים בניסוי ישלימו 26 שבועות של השתתפות בניסוי. ניתוח הביניים השני של ועדת ה- DSMB יכלול ניתוח ביניים של נתוני בטיחות ויעילות, כמו גם הערכה של האפשרות לעצירה מוקדמת של הניסוי במקרה של הצלחה, בכפוף לקריטריונים אשר נקבעו מראש. ניתוח זה יספק הזדמנות לקיצור הזמן עד להשלמת הניסוי במקרה בו הועדה תזהה יעילות מובהקת ובאופן פוטנציאלי תזרז את תהליך נעילת הנתונים עם השלמת הניסוי.
– השינויים בתכנון הסטטיסטי של הניסוי יאפשרו לבצע ניתוח של נתונים רציפים. במקרה שוועדת ה- DSMB השנייה, אשר תערך ברבעון השני של 2017, תמצא כי הניסוי עומד בקריטריון אשר נקבע מראש למובהקות סטטיסטית, הניסוי עשוי להיעצר בשל יעילות או חוסר-יעילות. היה ובחינת ועדת ה- DSMB תמצא כי בעת קיום ניתוח הביניים הניסוי אינו עומד בקריטריון המובהקות הסטטיסטית אשר נקבע מראש, אזי הניסוי ימשיך כמתוכנן עד להשלמת גיוס כל 410 החולים ומעקב עד לשבוע 26, כאשר בחינת יעילות סופית תעשה בשימוש בערך-p דו-צדדי של 0.049.
– הגדלת מספר החולים בניסוי שלב III עם RHB-104 מיועדת גם בכדי לאפשר איסוף של כמות גדולה באופן משמעותי של מידע אנדוסקופי על החלמת רירית המעי, אשר נועד לתמוך בבקשות פוטנציאליות עתידיות לאישור שיווק של התרופה. השינוי בפרוטוקול משקף ותואם להנחיות האחרונות של מנהל המזון והתרופות האמריקאי (ה- FDA) ורשות התרופות האירופאית (ה- EMA).
– ניתוח ביניים שלישי של ועדת DSMB בלתי-תלויה מתוכנן כאשר 75% מ- 410 החולים ישלימו 26 שבועות של השתתפות בניסוי ויתמקד בנתוני בטיחות.
– על-מנת לשפר את שימור החולים בניסוי ולזרז עוד יותר את קצב גיוס החולים, רדהיל מתכוננת להתחיל בניסוי תווית-פתוחה, אשר יהווה הרחבה של הניסוי שלב III עם RHB-104, במסגרתו יוצע לחולים אשר השלימו 26 שבועות של טיפול, ואינם מאובחנים בנסיגה של המחלה (CDAI>150), לקבל טיפול באמצעות RHB-104 למשך 52 שבועות.
– על-מנת לזרז אף יותר את גיוס החולים לניסוי שלב III ולהרחיב את המידע הנאסף באירופה, רדהיל מגדילה את מספר המרכזים הקליניים באירופה על-ידי הוספה של
כ- 30 מרכזים קליניים נוספים ב- עד 4 מדינות אירופאיות נוספות. בכך רדהיל יותר ממכפילה את מספר המרכזים הקליניים באירופה המתוכננים לגייס חולים לניסוי שלב III עם RHB-104.
– בחודשים הקרובים רדהיל מתכננת להתחיל שני ניסויים קליניים קטנים עם RHB-104 מחוץ לארה”ב, אשר יהיו במתכונת של תווית-פתוחה ויכללו עד ל- 20 חולי קרוהן כל-אחד. ניסויים אלו מיועדים לספק מידע קליני תומך נוסף עבור בקשות פוטנציאליות עתידיות לאישור שיווק של RHB-104 ולבחון את היעילות של RHB-104 כטיפול משלים לטיפולים מקובלים בחולי קרוהן אשר אובחנו רק לאחרונה ולא טופלו קודם לכן בטיפול תרופתי.
– הניסוי שלבIII עם RHB-104 יוותר כניסוי כפול-סמיות ורדהיל לא תיחשף לנתונים מניתוחי הביניים ולתוצאות אשר יתקבלו במהלך הניסוי. לא מתוכננים שינויים ביעד העיקרי של הניסוי ובעוצמה הסטטיסטית המתוכננת של 90%. בהנחה כי כל 410 החולים יגויסו לניסוי, השלמת גיוס החולים צפויה עד לסוף 2017.
– רדהיל שמרה על מאזן נטול-חוב עם כ- 47.7 מיליון דולר במזומן ושווה ערך למזומן בסוף הרבעון השני של 2016. שריפת המזומנים ברבעון השלישי של 2016 כתוצאה מהשינויים המתוארים לעיל הייתה חסרת משמעות. שריפת המזומנים הכוללת הצפויה כתוצאה מהגדלת מספר החולים בניסוי והתחלת הניסוי תווית-פתוחה כהרחבה של ניסוי שלב III עם RHB-104, עד למועד הפגישה השנייה של ועדת ה- DSMB והערכת האפשרות לעצירה מוקדמת של הניסוי, עומדת על כ- 6 מיליון דולר.
שני ניסויים לא-קליניים אשר נערכו לאחרונה על-ידי חוקרים מבית-הספר לרפואה באוניברסיטת מרכז פלורידה (UCF) הדגימו כי הפורמולציה מוגנת הפטנט של RHB-104, המכילה שלושה חומרים פעילים בקפסולה יחידה, צפויה להיות בעלת יעילות עדיפה בהדברת זיהום של חיידק
ה- MAP בהשוואה למתן של שלושת האנטיביוטיקות כמרכיבים נפרדים, וכי לשלושת החומרים הפעילים של תרופת RHB-104, בריכוזם היעיל המינימאלי, פעילות סינרגטית בעיכוב של התפתחות חיידק ה- MAP בהשוואה למתן של חומר פעיל אחד בלבד או שילוב של שניים מהחומרים הפעילים.
רדהיל תערוך שיחת ועידה, היום, יום חמישי ה- 6 באוקטובר 2016, בשעה 15:30 שעון ישראל, בה תציג את העדכונים לתכנית הפיתוח שלב III עם RHB-104. השיחה תועבר באופן ישיר באתר החברה. שידור שמע בלבד יהיה זמין דרך הטלפון. לפרטים על הדרכים להצטרף לשיחת הועידה יש לגשת לאתר החברה: http://ir.redhillbio.com/events.cfm
אודות רדהיל:
רדהיל ביופארמה (נאסד”ק/ת”א: RDHL) הינה חברת פרמצבטיקה הממוקמת בישראל ומתמקדת בתרופות אוראליות, מסוג מולקולות קטנות, מוגנות פטנט בשלבי פיתוח קליניים מתקדמים לטיפול ומחלות הקשורות לדרכי העיכול ובמחלות דלקתיות ובכלל זה סרטן. צנרת התרופות הנוכחית של החברה כוללת: (i) RHB-105 – קומבינציה במתן אוראלי לטיפול בזיהום של חיידק ה- Helicobacter pylori – עם תוצאות חיוביות מניסוי שלב III ראשון; (ii)RHB-104 – קומבינציה במתן אוראלי לטיפול במחלת הקרוהן – ניסוי שלב III ראשון מתנהל כעת, ולטיפול בטרשת נפוצה – ניסוי שלב IIa מתנהל כעת; (iii) BEKINDA® (RHB-102) – תרופה במתן כדור חד-יומי אוראלי של חומר הפעיל ondansetron למניעת בחילות והקאות עם ניסוי שלב III המתנהל כעת לטיפול בגסטרואנטריטיס חריפה וגסטריטיס, וניסוי שלב II המתנהל כעת לטיפול בתסמונת המעי הרגיז; (iv) RHB-106 – כדור אוראלי לריקון המעי כהכנה לפרוצדורות רפואיות אשר נמכרה בהסכם רישיון כלל-עולמי ל- Salix Pharmaceuticals Ltd. (v) (ABC294640) YELIVA® – תרופה חדשנית, מעכבת SK2 במתן אוראלי, הנמצאת בשלב II ומיועדת לטיפול בסרטן, מחלות דלקתיות ומחלות בדרכי העיכול; (vi) MESUPRON – תרופה חדשנית, מעכבת uPA במתן אוראלי, המיועדת לטיפול בגידולים סרטניים של דרכי העיכול וגידולים סרטנים מוצקים נוספים – שני ניסויי שלב II הושלמו; (vii) RP101 תרופה חדשנית, מעכבת Hsp27 במתן אוראלי, לטיפול בסרטן הלבלב וגידולים סרטניים של דרכי העיכול. בוצעו ניסויי שלב II ורכישת התרופה נבחנת במסגרת הסכם אופציה של רדהיל לרכישה; (viii) RIZAPORT (RHB-103) – דפית מסיסה אוראלית המכילה rizatriptan לטיפול במיגרנה, אשר בגינה הוגשה בקשה לאישור שיווק בארה”ב הנמצאת בבחינה של ה- FDA ונתקבל אישור שיווק בגרמניה באוקטובר ;2015 (ix) RHB-101 – תרופה במתן כדור חד-יומי של החומר הפעיל carvedilol לטיפול באי–ספיקת לב וביתר לחץ דם. למידע נוסף: www.redhillbio.com











השאירו תגובה
רוצה להצטרף לדיון?תרגישו חופשי לתרום!