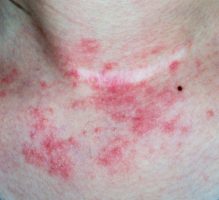
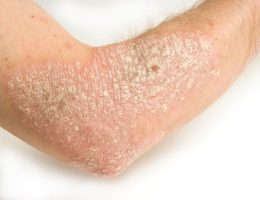
ועידת CHMP (או Committee for Medicinal Products for Human Use) מטעם סוכנות התרופות האירופית (European Medicines Agency) המליצה על אישור שיווק Lebrikizumab לטיפול באטופיק דרמטיטיס בחולים בגילאי 12 שנים ומעלה.
הנציבות האירופית בוחנת כעת את המלצת הועדה אודות Lebrikizumab, מעכב Interleukin-13 ניסיוני, לטיפול באטופיק דרמטיטיס בדרגה בינונית-עד-חמורה. על-פי ההודעה לעיתונות, החברה מצפה כעת כי התכשיר הביולוגי יאושר לשימוש באיחוד האירופי בתוך חודשיים.
ההמלצה החיובית של ועידת CHMP לחולים עם אטופיק דרמטיטיס בדרגה בינונית-עד-חמורה מהווה אבן דרך משמעותית בפיתוח טיפול ביולוגי מהדור הבא לחולים עם אטופיק דרמטיטיס, צעד אשר יספק אפשרות טיפול נוספת.
העמדה החיובית של הועדה מבוססת על תכנית המחקרים הקליניים של חברת התרופות, הכוללת את Advocate 1, Advocate 2 ו-ADhere.
בשני המחקרים הראשונים, למעלה מ-50% מהחולים שטופלו ב- Lebrikizumab בלבד השיגו ירידה של לפחות 75% בחומרת המחלה לאחר 16 שבועות. במחקר ADhere, בקרוב ל-70% מהחולים תועדה ירידה של 75% בחומרת המחלה בעקבות משלב Lebrikizumab עם טיפול מקומי בקורטיקוסטרואידים.
המחקרים מצאו עוד כי Lebrikizumab הינו טיפול בטוח לשימוש , כאשר תופעות הלוואי הנפוצות ביותר היו בדרגת חומרה קלה-עד-בינונית.
בחברת התרופות ממתינים כעת להחלטה הרשויות אודות הרחבת המוצר לשווקים אירופאיים נוספים, כולל בריטניה ושוויץ בשנת 2024.
מתוך הודעת ה-EMA














השאירו תגובה
רוצה להצטרף לדיון?תרגישו חופשי לתרום!