(מתוך: “Clinical Research Focus”, Volume 17, issue 5, May 2006)
1. כללי
עריכתו של מחקר בודד עשויה לעלות בממוצע בין 100 אלף למיליון דולר אמריקאים. משמעות נתון זה היא כי כל אחד הזקוק להוכחות קליניות התומכות בטענה של בטיחות, יעילות או כל נתון שווה ערך משמעותי אחר, חייב לתת תשומת לב רבה לשלבי תכנון וביצוע המחקר הקליני. תעשיית התרופות עומדת בפני אתגרים רבים בבואה להגביר את היעילות של תהליכי פיתוח התרופות ואת החזר ההשקעה הכספית. השגת אתגרים אלו הופכת משימה קשה עוד יותר לנוכח תהליך הפיכתם של המחקרים הקליניים ליקרים ומורכבים יותר.
2. קווי יסוד לתוצאות מוצלחות במחקר
ישנם כמה קווי יסוד בפיתוח פרוטוקולי מחקר והליכי ביצוע, המהווים נקודות מפתח בקביעת תוצאה מוצלחת למחקר:
· זיהוי השאלות הספציפיות אשר ייבחנו והמדדים על פיהם ייבחנו התוצאות.
· קביעת גודל מדגם מתאים .
· קביעת הליך הרנדומיזציה.
· פירוט ההתערבות על ידי קביעת לוחות זמנים לביקורי המעקב של החולה המיועדים להערכה.
· קביעת תכנית לאיסוף מידע בזמני ביניים ותכנית ניטור בטיחות.
· פירוט תכנית ניתוח התוצאות הסופית וקביעת המבנה הארגוני
3. גורמים העשויים להגביר את עלויות המחקר
3.1 זמינות החולים
גורמי המפתח בעריכה מוצלחת של מחקרים קליניים הם מהירות, איכות ועלויות, כאשר גיוס החולים הוא הסוגייה העיקרית. אי היכולת לגייס חולים כפי שתוכנן גרמה עיכובים משמעותיים בהתקדמותם של מחקרים קליניים- שבסופו של דבר הביאו לעלויות גבוהות ולאבדן מכירות פוטנציאליות. אחד ממקורות בזבוז הכסף והזמן העיקריים בעריכתם של מחקרים קליניים הוא אתר מחקר שאינו מתפקד או שמתפקד בצורה לא אופטימלית. גיוס איטי של חולים למחקר קליני לא זאת בלבד שמאריך את זמן פיתוח המחקר אלא שהוא גם יקר מאוד מהבחינה הכספית. בהערכה של תרופה חדשה המתעתדת לייצר מכירות של כמיליארד דולר לשנה, ניתן לחשב שכל יום שנחסך שווה ל- 2.74 מיליון דולר ברווח כספי.
3.2 הדיוק בחיזוי גיוס החולים
מדיווחים קודמים אנו למדים שגיוס חולים אחראי ל- 42% מהעיכובים המשמעותיים בעריכת מחקרים קליניים, כאשר רק 80% מהאתרים עומדים במטרות לוחות הזמנים לגיוס שהוצבו להם. התגובה הסטנדרטית במצב זה היא לפתוח אתר מחקר במיקום אחר, על כל המשתמע מכך בעלויות נוספות והארכת לוחות הזמנים לגיוס חולים. מאחר שכך, המאמץ שנעשה על מנת לקבוע חיזוי מדויק ככל האפשר של גיוס החולים, ועל מנת לשפר את הליך הגיוס עבור החוקרים והחולים כאחד הוא קריטי לניסיון מיזעור העלויות הכרוכות בנקודת תורפה זו.
3.3 איכות המחקר הקליני
בחירת צוות המחקר הינה קריטית להצלחתו של המחקר הקליני. איכות צוות המחקר היא בעלת חשיבות עליונה בעמידה במטרות המחקר. יכולתו של הצוות לגייס חולים, לשמר אותם במחקר ולייצר נתונים מהימנים (ככל האפשר) היא קריטית.
3.4 עלויות
ניתן לצמצם עלויות על ידי גיוס מספר גדול יותר של חולים במספר מועט יחסית של אתרי מחקר, מה שמאפשר ניטור יעיל יותר ומוריד את עלויות הנסיעה של צוות נציגי המחקר הקליני (Clinical Research Associates CRAs). בנוסף, מממן המחקר עשוי לחסוך זמן באם יידון בנושאי חוזה ותקציב עם מספר מועט ככל הניתן של נציגים (ובאופן אידיאלי נציג אחד), באתרי מחקר שכבר מכירים את ה- GCP ואת הדרישות המוצבות על ידי רגולציות המחקר המקומיות.
4. מחקרים קליניים בישראל
עריכת מחקרים קליניים בישראל עשויה להיות בעלת השפעה חיובית על חלק מהבעיות הפוטנציאליות שתוארו לעיל.
4.1 איכות החינוך הרפואי ועריכתם של מחקרים קליניים
א. קשרים קרובים בין רופאים ישראלים לעמיתיהם בארה”ב תרמו להנהגת מדיניות רפואית הדומה לזו הנהוגה בצפון אמריקה במרבית תחומי הרפואה השונים. רופאים ישראלים רבים קיבלו הכשרה ברמה גבוהה בחו”ל, ובעיקר בארה”ב, או במסגרת של התמחות על (Fellowship) או במסגרת היותם מהגרים לישראל. רופאים רבים החוזרים מארה”ב הם בעלי ניסיון רב בניהול מחקרים קליניים כחוקרים, והינם מתורגלים בקווי ההנחיה (Guidelines) של ה- ICH-GCP. רמת היכרות כזו בקרב חוקרים מנוסים מביאה ליישומו של חלק משמעותי מהניהול היעיל של המחקר הקליני.
ב. ביבשת אירופה המחקר הקליני אינו עומד בציפיות במשך שנים רבות, כאשר אחד המכשולים העיקריים הוא שהמחקר הקליני נתפס ככזה הנעשה בדרך כלל במקביל לעבודה שוטפת במשרד או בבית החולים. שלא כמו בארה”ב או בישראל, אחיות מחקר במשרה מלאה הן יוצאות דופן במרבית המוסדות האירופאיים, עובדה התורמת לעיכובים בתהליכי עריכת המחקר.
4.2 מערכת הבריאות
מרפאות החוץ, בין אם בבית החולים ובין אם בקהילה הן אבן היסוד של מערכת הבריאות בישראל. שלא כמו במדינות רבות אחרות, ישנו שיתוף פעולה קרוב בין רופאי הקהילה לרופאי המחלקות השונות בבתי החולים, כמו גם זיקה עמוקה בין בתי החולים לבין בתי ספר אוניברסיטאיים לרפואה. כל אלו תורמים לטיפול יעיל בחולה.
4.3 הקשר רופא- חולה
א. בישראל, הקשר בין הרופא לחולה באופן כללי מאופיין באמון, מחוייבות, ותחושת השייכות ל”משפחה אחת”. כל שלושת האספקטים הללו תורמים באופן משמעותי לאמון הדדי בכל הקשור לטיפול בחולה, כולל הסיטואציה של מחקר קליני הדורש הסכמה מדעת וכל האספקטים הקשורים לו. חולים לעתים קרובות רוצים לתרום להתקדמותה של הרפואה, ולכן הנכונות הכללית להשתתף במחקרים קליניים היא גבוהה.
ב. שיעור ההיענות בכל הנוגע לביקורי מעקב במחקר ה- INSIGHT Coronary Calcification Substudy” היה 93% וחולים מ- 17 מרכזים ברחבי ישראל התייצבו לביקורים שנתיים במרכז אחד. זוהי דוגמא למחוייבות החולים הישראלים לרופאיהם.
4.4 שוק תרופות קטן
ישראל אינה שוק מפתח עבור חברות התרופות, מאחר ואוכלוסייתה קטנה. למרות האמור לעיל, השגת יעדי ההתפתחות הקליניים היא גורם שאינו תלוי בשוק, והיותו של השוק קטן אינה קשורה באופן פרקטי לביצוע המחקר. סימוכין לכך ניתן למצוא בתרומתם הרבה של מרכזים ישראליים למחקרים קליניים בינלאומיים, המגיעה לכ- 9% מסך החולים המשתתפים במחקרים אלו.
4.5 הליכי אישור מחקר
הזמן הממוצע לאישור מחקר בודד נע בין חודש לארבעה חודשים, כתלות במורכבות המחקר. החוק בישראל קובע כי חוקר מכל אתר יגיש בקשה לאישור בוועדת הלסינקי (וועדת אתיקה) בבית החולים, אשר מעבירה את הבקשה למחלקת התרופות במשרד הבריאות. מחלקה זו מתייעצת עם הוועדה המרכזית למחקרים קליניים לשם מתן אישור המועבר למנהל הכללי של בית החולים לאישור סופי. מחקרים הנחשבים ב”סיכון נמוך” בעיני וועדות הלסינקי של בית החולים עשויים להיות מועברים ישירות למנהל הכללי של בית החולים לשם אישור סופי, כאשר נדרשת הודעה בלבד לרשויות הבריאות. הגורם מגביל- הקצב להתחלת המחקר הוא במרבית המקרים, הוא ההסכמה עם אתרי המחקר. סוגייה זו נפתרה לאחרונה עם כניסתם לשימוש של תבניות הסכמים המוכנות מראש, אשר ניתן להשתמש בהן ללא דיונים נוספים במעבר ממחקר אחד לשני. דוגמא יוצאת דופן היא זמן אישור של חודש אחד בלבד למחקר בינלאומי גדול שנערך בתרופה המיועדת להורדת שומנים בדם (ליפידים) כמניעה שניונית של התקפי לב.
4.6 עלויות
ככלל, עלויות המחקר הינן תחרותיות עם אלו המקובלות בצפון אמריקה ובאיחוד האירופי. השתתפותו של חולה במחקר אינה מערבת נטל כלכלי נוסף על מערכת הביטוח הלאומי שאינו מחוייב בהוצאות הנלוות למחקר.
4.7 ארגוני מחקר קליני
ארגוני מחקר קליני (Clinical Research Organizations- CROs) משרתים את תעשיית התרופות מזה 20 שנה. הם בעלי ידע נרחב בביצוע מחקרים קליניים בישראל, ומשלבים מומחים מקצועיים עם מתקנים רפואיים ומדעיים מהשורה הראשונה בכל רחבי המדינה. הם משמרים יחסים הדוקים וארוכי טווח עם מעצבי דעות מובילים מטווח רחב של תחומי תעשיית התרופות השונים, והמרכזים המשתתפים כוללים לעתים קרובות יחידות אקדמיות עולמיות מובילות עם מוניטין בינלאומי של מצויינות. העבודה כולה מבוצעת ומנוטרת מהבחינה הכלכלית על פי דרישות ה- ICH-GCP.
4.8 תיעוד ההצלחות
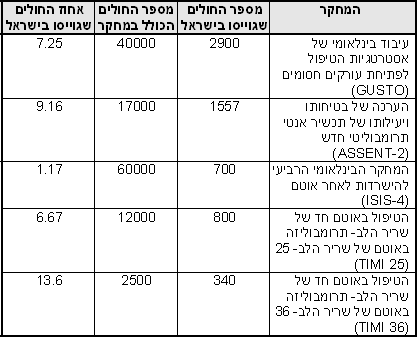
טבלאות 1 ו- 2 מספקות דוגמאות למחקרים גדולים ומוצלחים אשר בוצעו בישראל:
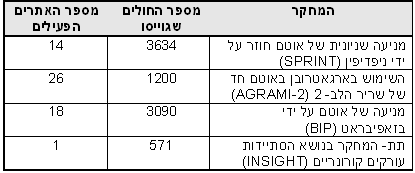
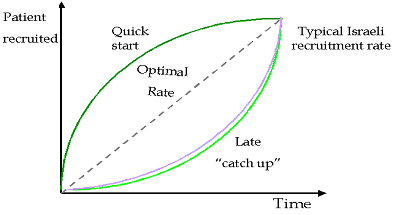
טבלה 2: דוגמאות למחקרים בקנה מידה גדול להם תרמו מרכזים ישראליים מספרי החולים המופיעים במחקרים אלו, שהסתיימו בהצלחה ואף פורסמו מדגישים את יעילותם של החוקרים הישראלים בתחום זה. 4.9 השתתפות חולים בבואו לחזות את גיוס החולים הצפוי, על החוקר להעלות ניחוש מושכל. גם בהינתן מודל יישום טוב באתר המחקר, ניחוש זה עשוי להיות מוטעה, לעתים בשל נטייתם של החוקרים להיות אופטימיים במידה יתרה בכל הנוגע לגיוס חולים. ב- 1979 לזניה ציין מחקר בו מתוך 8027 מועמדים אפשריים, השתתפו רק כמאה. נתון זה הוביל למה שהיום מכונה חוק לזניה: למשך זמן המחקר, שיעור ההיארעות של המחלה באוכלוסיה יופחת ל- 10% מההערכה המקורית, ויוחזר למספר המקורי עם תום המחקר (תרשים 1) השתתפות החולים עשויה להיות שונה בין מחקרים שונים ובין אתרי מחקר שונים (תרשים 2). תרשים 2: תרחישי השתתפות חולים במחקרים קליניים ההשתתפות הישראלית האופיינית היא לפי מודל “התחלה איטית- הדבקת יעד מהירה”, אשר כמעט תמיד עומד בדרישות הנתונות. המצב הגיאו- פוליטי מהווה מקור לדאגה מזה עשרות רבות של שנים. יחד עם זאת, למרות התרחשותם של מצבים קריטיים במהלך 20 השנה האחרונות, הסביבה הפוליטית הבלתי יציבה לא השפיעה על ביצועי המחקר הקליניים. 5. סיכום ביצועי המחקרים הקליניים בישראל מתאפיינים באיכות גבוהה ועלויות תחרותיות בהשוואה למחקרים דומים המבוצעים בצפון אמריקה או באיחוד האירופי. נתונים בסיסיים הקשורים בהכשרתו של החוקר, ניסיון בעבודה עם ICH-GCP, הליכי אישור הוועדות האתיות ונכונותם של החולים לשתף פעולה כמו גם ניסיונם הרב של החוקרים, תומכים בעריכתם של מחקרים קליניים במדינה זו. כל שלבי המחקר הקליני יכולים להיות מבוצעים, ומטרות המהוות אבני דרך יכולות להיות מושגות. ביבליוגרפיה
1. Stark NJ. A long road: 25 years of clinical research. Medical Device et. Diagnostic Industry 2004; 26(8): 96-101. 2. Friedman LM, Furberg CD, DeMets DL. Fundamentals of clinical trials. 3rd ed. New York: Mosby-Year Book Inc,; 1996. 3. Division of Biostatistics Office of Surveillance and Biometrics. Statistical guidance for clinical trials on non-diagnostic medical devices: Center for Devices and Radiological Health. U.S. Food and Drug Administration; 1996. 4. Fung SM, Suean E, Lee HB. Development of a patient recruitment program for phase 2 trials in a biotechnology company. Drug Information Journal 2003; 37: 259-270. 5. Losing ground against development delays. CentreWatch Newsletter 1998; 5(12). 6. Motro M, Shemesh J. Calcium channel blocker nifedipine slows down progression of coronary calcification in hypertensive patients compared with diuretics. Hypertension 2001; 37(6): 1410-3. 7. Eriksson BL, Borris L, Dahl OE et al. Oral, direct Factor Xa inhibition with BAY 59-7939 for the prevention of venous thromboembolism after total hip replacement. J Thromb Haemost 2006; 4(1): 121-8. 8. Poole-Wilson PA, Lubsen J, Kirwan B-A et al. Effect of long-acting nifedipine on mortality and cardiovascular morbidity in patients with stable angina requiring treatment (ACTION trial): randomized controlled trial. Lancet 2004; 364: 849-857. 9. Behar S, Tanne D, Zion M et al. Incidence and prognostic significance of chronic atrial fibrillation among 5,839 consecutive patients with acute myocardial infarction. The SPRINT Study Group. Secondary Prevention Reinfarction Israeli Nifedipine Trial. Am J Cardiol 1992; 70(7): 816-8. 10. Neufeld HN. Calcium antagonists in secondary prevention after acute myocardial infarction: The Secondary Prevention Reinfarction Nifedipine Trial (SPRINT). Eur Heart J 1986; 7 Suppl B: 51-2. 11. Rott D, Behar S, Hod H et al. Improved survival of patients with acute myocardial infarction with significant left ventricular dysfunction undergoing invasive coronary procedures. Am Heart J 2001; 141(2): 367-76. 12. Secondary prevention by raising HDL cholesterol and reducing triglycerides in patients with coronary artery disease: the Bezafibrate Infarction prevention (BIP) study. Circulation 2000; 102(1): 21-7. 13. An international randomized trial comparing four thrombolytis strategies for acute myocardial infarction, The GUSTO investigators. N Engl J Med 1993; 329(10): 673-82. 14. Single-bolus tenecteplase compared with front-loaded alteplase in acute myocardial infarction: the ASSENT-2-double-blind randomized trial. Assessment of the Safety and Efficacy of a New Thrombolytic Investigators. Lancet 1999; 354(9180): 716-22. 15. Group I-FISoISC. ISIS-4: a randomized factorial trial assessing early oral captopril, oral mononitrate and intravenous magnesium sulphate in 58,050 patients with suspected acute myocardial infarction. Lancet 1995; 345(8951): 669-685. 16. Antman EN, Morrow DA, McCabe CH et al. Enoxaparin versus unfractionated heparin as antithrombin therapy in patients receiving fibrinolysis for ST-elevation myocardial infarction. Design and rationale for the Enoxaparin and Thrombolysis Reperfusion for Acute Myocardial Infarction Treatment – Thrombolysis in Myocardial Infarction study 25 (ExTRACT-TIMI 25). Am Heart J 2005; 149(2): 217-226. 17. Marzilli M. Ranolazine CV therapeutics. Curr Opin Investing Drugs 2005; 6(3): 336-343. 18. Lasagna L. Problems in publication of clinical trial methodology. Clin. Pharmacol Ther 1979; 25: 751-753.
חוק לזניה (Lasagna`s law)
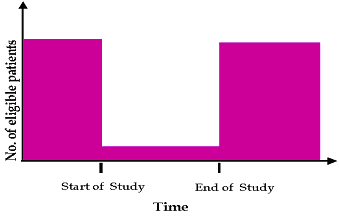 תרשים 1: חוק לזניה
תרשים 1: חוק לזניה
4.10 דפוסי השתתפות










השאירו תגובה
רוצה להצטרף לדיון?תרגישו חופשי לתרום!