עיתון “הארץ” פירסם בתחילת דצמבר את כתבתו של פרופ’ עמוס כץ, מנהל המערך הקרדיולוגי, מרכז הרפואי ברזילי אשקלון. לעיונכם, הכתבה המלאה שחלקים נבחרים ממנה פורסמו במוסף “בריאות”.
מבוא
פרפור פרוזדורים (פ”פ) – Atrial Fibrillation – היא הפרעת קצב הלב המתמשכת השכיחה ביותר. שכיחותה עולה עם התבגרות האוכלוסייה והעלייה בתוחלת החיים. מרבית החולים הסובלים מפ”פ הם מעל גיל 65. המרכז האמריקאי לבקרת מחלות (CDC) דיווח לאחרונה על עלייה של 240% בשיעור האשפוזים עקב פ”פ כאבחנה עיקרית בחולים מעל גיל 35. שכיחות פ”פ באוכלוסייה הכללית היא 0.95%. השיעור הוא 0.1% במבוגרים מתחת לגיל 50 ומגיע ל-9% מעל גיל 80. המידע לגבי שכיחות המחלה בארץ מוגבל אולם במחקר שנערך לאחרונה במרפאות קהילה באזור באר שבע נמצא ששיעור החולים בארץ עם פ”פ דומה לשיעור בארה”ב. ההפרעה שכיחה מעט יותר בגברים לעומת נשים. בעבר רוב חולים שסבלו מפ”פ סבלו מפגיעה במסתמי הלב פ”פ מסתמי, החל במחצית השנייה של המאה העשרים, אצל מרבית החולים המבוגרים הסובלים מפ”פ אינם סובלים ממחלת לב מסתמית אולם הם סובלים ממחלות רקע כגון מחלת לב כלילית, יתר לחץ דם, סוכרת, הפרעות נשימה ושינה, משקל עודף, שתיית אלכוהול ופעילות יתר של בלוטת התריס אשר קשורות אך אינן גורמות ישירות להיארעות פ”פ. מבין הסובלים מפ”פ ב -5% עד 31% לפי מחקרים שונים אין כל מחלות רקע הקשורות לפ”פ – הפרעת הקצב מופיעה באדם בריא.
פ”פ היא הפרעת קצב הגורמת לאורך זמן להכפלת התמותה והתחלואה ממחלות לב וכלי דם והיא הסיבה השכיחה ביותר לאירוע מוחי תסחיפי.
הפרעת קצב זו מתוארת כבר בעידן הקדום לדוגמא הרמב”ם תיאר כבר בשנת 1187 דופק בלתי סדיר אשר היה ככל הנראה פ”פ ולדעתו נובע מבעיות לב, בעיות בקיבה או בעיות ב”כוח”.
מנגנון הפרעת הקצב:לצורך הבנת הפרעת הקצב, נסקור בקצרה את מבנה הלב ופעילותו.
הלב הינו איבר שרירי חלול הפועל כמשאבה. הוא אחראי לאספקת הצרכים המטבוליים של הגוף ע”י הזרמת דם לכל חלקי הגוף, דם מועשר בחמצן החיוני לתפקידו. הלב ממוקם במרכז החזה ומחובר לגוף באמצעות כלי הדם הגדולים. הלב בנוי מארבעה מדורים, שני מדורים בצד שמאל של הלב ושני מדורים בצד ימין (תמונה מס 1).
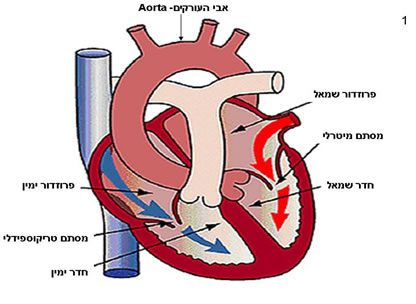
המדור העליון בכל צד קרוי פרוזדור (Atrium) ומדור התחתון קרוי חדר (Ventricule). בין כל עליה וחדר קיים מסתם (Valve), וכן קיים מסתם בכל אחד מן היציאות שבחדרים. העלייה הימנית קולטת את הדם שעה שהוא מוחזר מן הגוף באמצעות מערכת הוורידים הנבובים העליון והתחתון, ממנה הדם עובר לחדר הימני המזרים את הדם לראות דרך עורק הריאה, לצורך קליטת חמצן ופליטת דו תחמוצת הפחמן (המחזור הקטן). העלייה השמאלית קולטת את הדם מן הראות דרך ורידי הריאה והחדר השמאלי מזרים את הדם לכל אברי הגוף (המחזור הגדול) דרך אבי העורקים.
ארבעת המדורים פועלים בצורה מתואמת באמצעות הפעלה חשמלית של הלב (תמונה מס 2) .
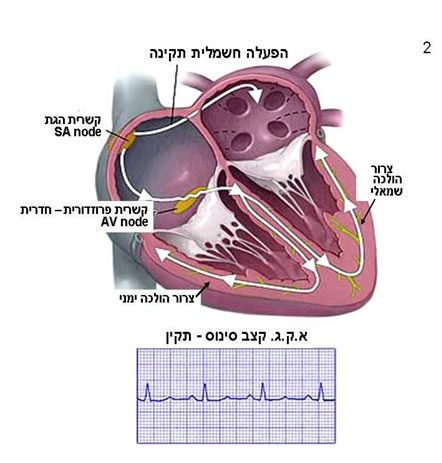
הלב מצויד בקוצב חשמלי טבעי הממוקם בעליה הימנית של הלב, וניקרא: קשרית הגת (Sinus node). איבר זה קובע את קצב פעימות הלב, קצב הקרוי קצב סינוס. מהירות קצב הסינוס הממוצעת במבוגר במנוחה היא בין 90-60 פעימות לדקה. קצב הלב מושפע מצרכי הגוף, הסינוס מקבל אותות מעצבים מיוחדים המגיעים ללב וכן מושפע מחומרים המופרשים בזרם הדם כגון אדרנלין.
הגירוי החשמלי אשר מתחיל בקשרית הגת עובר בפרוזדורים וגורם להם להתכווץ ולהזרים את הדם לחדרים. מן הפרוזדור הימני הגירוי החשמלי מגיע אל צומת מרכזית באמצע הלב, הנקראת : קשרית פרוזדורית חדרית (A-V node) אשר ממוקמת בין הפרוזדורים לחדרים. ה- AV node משמש תחנת מעבר אשר בה מואט הגירוי החשמלי ומשתהה עד הגיעו לחדרים. בלב בריא זה הקשר החשמלי היחיד בין הפרוזדורים לחדרים.
הגירוי החשמלי עובר מהקשרית פרוזדורית- חדרית לחדרים דרך סיבי שריר מיוחדים ודקים המתפקדים כ “חוטי חשמל”. הגירוי החשמלי גורם לחדרים להתכווץ ולהזרים את הדם לגוף.
פרפור פרוזדורים:
פרפור פרוזדורים הינה הפרעת קצב אשר מקורה בפרוזדורים. בעת פ”פ ההפעלה החשמלית של הפרוזדורים אינה ממקור הסינוס הטבעי, אלא ממספר רב של מעגלים חשמליים לא תקינים. לעיתים תכופות הגורם להפעלת מעגלים חשמליים אלו הינם מוקדים חשמליים עצמוניים ה”יורים” פעימות חשמליות מהירות מנקודת החיבור של ורידי הריאה לפרוזדור השמאלי. התוצאה הינה הפרעת קצב חשמלית בפרוזדורים המפעילה את הפרוזדורים בקצב מהיר מאוד של 350 500 פעימות לדקה (תמונה מס 3).
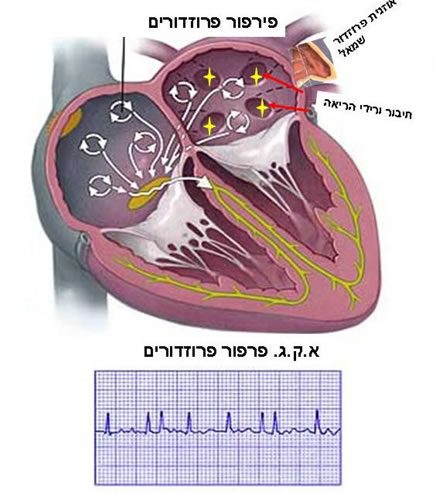
פ”פ מאופיין באק”ג כהפרעת קצב פרוזדורית מהירה ולא סדירה. קצב החדרים בזמן פ”פ הוא לרוב מהיר ובלתי סדיר ותלוי בתכונות ההולכה החשמלית הפרוזדורית-חדרית (A-V Node).
לפרפור פרוזדורים מספר סכנות:
מה חש חולה עם פ”פ?מגוון הסימנים והתסמינים של חולים עם פ”פ רחב מאוד. חלק מם החולים חשים בכל אירוע של פ”פ, מוטרדים מדופק מהיר ולא סדיר, סובלים מקוצר נשימה חולשה ירידה ביכולת התפקודית ולעיתים בחולי לב הדבר יכול לגרום גם להחמרת מצבם כולל הופעת תעוקה, בצקת בראות ועוד. מאידך ישנם חולים רבים שחשים סימפטומים מעטים או לא חשים כלל בקיום הפרעת הקצב.
סוגי פ”פקיימת שונות רבה בהופעה הקלינית של פרפור פרוזדורים. חלק גדול מן האירועים מתאפיינים באירועים לסירוגין (paroxysmal, persistent ) כלומר מעברים חוזרים מקצב סינוס לפ”פ – Recurrent הגורמים לתסכול לא מבוטל לחולים ולרופאים המטפלים. חלק מן החולים נמצאים באופן קבוע בפ”פ (permanent).
הערכה וברור של חולה עם פ”פ.כל חולה אשר מאובחן כסובל מפ”פ צריך לעבור ברור רפואי בסיסי הכולל
ההחלטה איזה בדיקות לבצע היא החלטת הרופא המטפל במרפאה, בחדר המיון או במסגרת מחלקה / מרפאה קרדיולוגית. בדיקות נוספות שיבוצעו במקרים מסוימים הינן מבחן מאמץ, הולטר, בדיקת קרדיו ביפר ובדיקה אלקטרופיזיולוגית (“צנתור חשמלי”) . יש להתאים הבדיקות לכל מטופל/ת.
הופעת הפרעת הקצב מעוררת דאגה רבה בקרב המטופלים בשל משמעותה ומשום שלעיתים ישנה נטייה לבלבל המינוח פ”פ עם פירפור חדרים אשר הינה הפרעת קצב שונה לחלוטין ומסכנת חיים.
הופעת פ”פ לרוב אינה ביטוי להתקף לב. הטיפול בפ”פ יכול להתבצע במרפאה, חדר מיון או במחלקת האשפוז. ההחלטה אם להפנות החולה לאשפוז צריכה להתבצע ע”י הרופא המטפל ואינה אוטומטית. הטיפול בפ”פ מתבצע לרוב בהנחיית קרדיולוג אולם מעורב בו גם רופא המשפחה וחלק גדול מן החולים עם פ”פ מאושפזים בארץ במחלקות פנימיות.
הגישה הטיפוליתבשנים האחרונות נצבר ידע רב בהבנת מנגנון וסיבוכי פ”פ, ונערכו מחקרים קליניים גדולים, רב מרכזים בעולם כולו אשר בדקו גישות לא תרופתיות ותרופות חדישות למניעה וטיפול בפ”פ ובסיבוכיו. לחידושים אלו השפעה על הגישה והטיפול בפ”פ.
תמונה מס 4 מסכמת את הגישה הטיפולית לחולה עם פ”פ. קיימות שלוש בעיות טיפוליות שיש להתייחס אליהן בכל חולה: א. מניעת תסחיפים, ב. האטת קצב הלב בזמן פ”פ,הנקראת בקרת קצב – ,Rate Control ג. החלטה אם להחזיר את החולה למקצב סינוס ולשומרו במקצב זה – Rhythm Control. המטרה היא לטפל בסימפטומים של החולה ולמנוע תחלואה ותמותה.

מניעת תסחיפיםמניעת תסחיפים בעיקר מניעת אירועים מוחיים היא נקודה מרכזית ועיקרית בטיפול בחולה עם פ”פ. בחולים אלו מתקיים מצב של קרישת יתר, המגביר את הסיכון לאירועים תסחיפיים.
טיפול תרופתי: הטיפול היעיל ביותר למניעת תסחיפים הינו נוגד קרישה הקרוי קומדין שהוכיח את יעילותו במניעת תסחיפים במספר רב של מחקרים. התרופה פועלת דרך עיכוב יצירת גורמי קרישה בכבד, הדורשים ויטמין K לצורך יצירתם. החיסרון הגדול של טיפול זה הינו הצורך בבדיקות דם תכופות לבדיקת רמות קרישת הדם INR וכן נטייה לדמם, אינטראקציה של התרופה עם מזון לדוגמא ירקות ירוקים ותרופות שונות. למרות יעילותה הרבה של התרופה הטיפול בה גורם לא מעט אי נוחות ומעמסה לחולה, לרופא ולשרותי הבריאות. הרמה התקינה (תפקוד קרישה תקין) של INR היא 1, הרמה הנדרשת בחולה עם פ”פ היא 2-3 (כלומר פחות נטייה ליצירת קרישים).
אספירין אשר מוכר כנוגד קרישה במנגנון אחר ויעיל בחולים עם מחלת לב כלילית נבדק בחולים עם פ”פ ונמצא פחות יעיל מקומדין בחולים עם סיכון בינוני לתסחיף עקב פ”פ.
עקב אי הנוחות הגדולה בשימוש בקומדין נמצאים בפיתוח ובמחקר מספר תרופות אשר אמורות להחליף הקומדין ולהקל על הטיפול בנוגדי קרישה. התרופה Dabigatran מעכבת ישירה של פקטור קרישה טרומבין נבדקה במחקר RE-LY ונמצאה יעילה מקומדין בחולים עם פ”פ. יתרונה הגדול של התרופה היא בכך שאין צורך בבדיקות דם חוזרות ואינה מושפעת מתרופות אחרות . התרופה אינה זמינה עדיין לשימוש אולם בעתיד תיכנס תרופה זו כתחליף לקומדין, דבר אשר יקל מאוד על הטיפול בנוגדי קרישה בחולים עם פ”פ. מחקר נוסף בתחום נוגדי הקרישה בחולים עם פ”פ מצא כי בחולים אשר אינם יכולים לקבל קומדין מסיבות שונות, שילוב של אספירין + פלוויקס (Clopidogrel ) יעיל יותר מאספירין בלבד. יש להדגיש כי קומדין יעיל יותר מאספירין + פלויקס ושילוב אספירין ופלויקס יינתן רק במידה וישנה הוראת נגד למתן קומדין.
כיצד מחליטים ומתאימים טיפול קבוע בנוגדי קרישה: בניגוד למקובל, הסיכון לתסחיף אינו משתנה במידה ומדובר בפ”פ קבוע או פ”פ לסירוגין. הסיכון לאירוע כזה תלוי בגורמי הסיכון של החולה לאירוע תסחיפי. בחולים עם מחלה במסתמי הלב הסיכון גבוה מאוד ומחייב טיפול נוגד קרישה קבוע בקומדין. בהעדר מחלה מסתמית הסיכון לאירוע מוחי נע בין 1.9% – 10% לשנה. ניתן לבצע הערכת סיכון לחולה עם פ”פ ללא מחלה מסתמית ע”י מתן “ציון” score הנקרא CHADS2 אשר מיועד לדרג את הסיכון התסחיפי בחולה עם פ”פ. גיל מעל 75 שנים, יתר לחץ דם, סוכרת ואי ספיקת לב מקבלים ניקוד של 1 ואירוע מוחי קודם מקבל ניקוד של 2. במידה והניקוד הכולל עולה על 1 רצוי טיפול בקומדין. במידה והציון הינו 1 או פחות ניתן להסתפק באספירין. במידה והציון גדול מ- 1 ולא ניתן לתת קומדין התחליף הרצוי הינו אספירין + פלוויקס.
יש לציין כי הטיפול בנוגדי הקרישה ימשך גם כאשר החולה בקצב סינוס בשל הנטייה להישנות אירועי פ”פ גם תחת טיפול תרופתי.
נוגדי קרישה לצורך היפוך קצבחולה אשר נמצא בפ”פ ונלקחה החלטה להחזירו לקצב סינוס ע”י תרופות או היפוך קצב חשמלי, יש להידרש לנושא נוגדי הקרישה, שכן עצם ההחזרה לקצב סינוס עלולה לגרום לאירוע תסחיפי. במידה ומדובר בפ”פ ללא מחלה מסתמית אשר נמשך פחות מ 48 שעות ניתן לבצע היפוך קצב ללא מתן נוגדי קרישה. בפ”פ אשר נמשך מעל 48 שעות יש להכין החולה משך 3 שבעות ע”י טיפול בקומדין או לחליפין ניתן לבצע אקו דרך הושט, כדי לשלול קיום קריש באוזנית של הפרוזדור השמאלי ואז לבצע את היפוך הקצב ע”י תרופות או היפוך חשמלי. לאחר החזרה לקצב הסינוס ההחלטה על המשך טיפול נוגד קריש/ה תתבצע לפי ציון הסיכון התסחיפי של החולה – CHAD SCORE.
טיפול לא תרופתי: לאחרונה הופיעו טיפולים לא תרופתיים למניעת תסחיפים. טיפולים אלו מבוססים על סגירת האוזנית של הפרוזדור השמאלי אשר הינה מקור התסחיפים העיקרי בפ”פ בשיטה מלעורית כלומר בצנתור ע”י מתקן דמוי מטרייה, המועבר לפרוזדור השמאלי וחוסם את יציאת קרישי דם מן האוזנית. כיום השימוש בשיטה לחסימה מלעורית של האוזנית מוגבל ומיועד לחולים שסבלו מאירועי תסחיפים חוזרים למרות טיפול בקומדין או שאינם יכולים לקבל טיפול נוגד קרישה ועדיין לא נמצא בשימוש שיגרתי בארץ. ניתן גם להסיר את האוזנית של העליה השמאלית בעת ניתוח לב פתוח המבוצע מסיבה אחרת, כגון להחלפת מסתם מיטרלי.
בקרת קצב הלב – Rate Controlקיימת חשיבות רבה לבקרה על קצב הלב האטת הקצב החדרי בכל מצב של פ”פ. לרוב הטיפול לבקרת קצב הינו טיפול תרופתי.
טיפול תרופתי:
תרופות המאטות את ההולכה מן הפרוזדור לחדר דרך ה-A-V Node. יש להתאים את התרופה למצב החולה ומחלות הרקע שלו.
המטרה בבקרת קצב הלב בעת פ”פ היא להגיע לדופק במנוחה מתחת ל-80 ובמאמץ לדופק של 110 עד 120 פעימות בדקה.
טיפול לא תרופתי:
כאשר לא ניתן להגיע לבקרת קצב הלב באמצעים תרופתיים. האלטרנטיבה היא השתלת קוצב לב ואבלציה (צריבה בגלי רדיו) של ה-A-V Node. הפעולה פשוטה מבחינה טכנית. בתום הפעולה נוצר חסם פרוזדורי-חדרי שלם, והחולה תלוי לרוב בקצב הקוצב. בצורה זו ניתן להשיג שליטה מוחלטת על קצב הלב, אין צורך בתרופות לבקרת קצב הלב, אולם יש להמשיך בטיפול נוגד קרישה. במרבית החולים העוברים פעולה זו חל שיפור רב באיכות החיים. הפעולה מומלצת לחולה המבוגר הנמצא בפ”פ קבוע או מרבית הזמן ושלא ניתן לשלוט בקצב הלב או שהוא נזקק למגוון רב של תרופות כדי לשלוט בקצב הלב.
קצב לעומת מקצב – Rate versus Rhythmההפעלה החשמלית המקורית והפיזיולוגית של הלב הינה מקצב הסינוס אשר מביא לתפקוד מיטבי של הלב. מגוון הטיפולים שעמד לרשות הרופאים עד לאחרונה כדי לשמור את החולה עם פ”פ במקצב סינוס לא היה רב וחלק מן הטיפולים כרוכים בתופעות לוואי רבות ומסוכנות. משום כך התעוררה השאלה המדעית מהי הגישה העדיפה בחולה עם פ”פ, החזרה ושמירה של מקצב סינוס ע”י תרופות לטיפול בהפרעות קצב ((anti arrhythmic, גישה הקרויה שמירת מקצב- ,Rhythm Control או השארת החולה בפ”פ והאטת קצב הלב – Rate Control. חמישה מחקרים שפורסמו לאחרונה בדקו את הנושא באופן ישיר. כולם הגיעו למסקנה כי בחולה המבוגר מעל גיל 60 לא נמצא הבדל בתמותה בין שתי גישות הטיפול. תוצאה דומה נמצאה גם בחולים עם אי ספיקת לב.
מחקרים אלו לא נועדו להוכיח כי פ”פ טוב יותר ממקצב סינוס שכן באופן כללי מצבו של החולה במקצב סינוס טוב ממצבו בפ”פ. אולם הבעיה הינה העדר טיפולים טובים ללא תופעות לוואי כדי לשמור את החולה במקצב סינוס. על סמך קבוצת מחקרים זו ניתן לומר, כי בקבוצת החולים בגיל מבוגר עם פ”פ בקרת הקצב טובה ובטוחה כשהחולים סובלים היטב את הפ”פ. מאידך בחולים אשר בזמן פ”פ למרות בקרת קצב לא חשים טוב, קיימת עייפות, חולשה, ירידה ביכולתם הגופנית והחמרת מחלות הרקע יש לטפל בגישת שמירת מקצב החזרתם לסינוס. קצב סינוס עדיף במידה וניתן לשמור את החולה בבטחה ללא תופעות לוואי בקצב סינוס.
החזרת קצב סינוס ושמירה עליו – Rhythm Control
החזרה לקצב סינוס: מוכרת במינוח היפוך קצב. ניתן להחזיר את החולה אשר נמצא בפ”פ לקצב סינוס בשיטה לא תרופתית ע”י היפוך קצב חשמלי – Electrical Cardioversion או בשיטה תרופתית ע”י מתן תרופות דרך הפה או דרך הוריד. לפני ביצוע החזרה של החולה לקצב סינוס יש להעריך את מצב הטיפול נוגד הקרישה ובחלק מן המקרים לבצע אקו דרך הושט וכן יש להחליט על הצורך בטיפול נגד הפרעות קצב בזמן ההיפוך ולאחריו. אין הבדל מבחינת הסיכון התסחיפי בין היפוך קצב חשמלי או תרופתי. היפוך קצב חשמלי מחייב הרדמה קצרת זמן ולרוב מתבצע על בסיס אשפוז יום. בידיים מיומנות שיעור הסיבוכים של שתי צורות ההיפוכים נמוך מאוד.
שמירת קצב סינוס ניתן לשמור על קצב סינוס בדרך תרופתית או בדרך לא תרופתית (תמונה מספר 5). הטיפול הבסיסי הוא תרופתי.
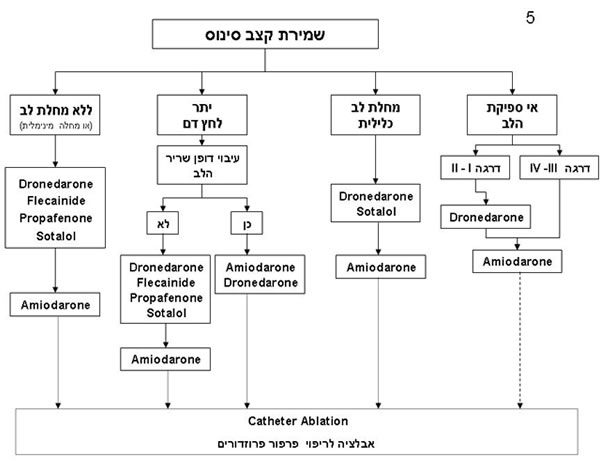
טיפול תרופתי לשמירת קצב סינוס: שיעור ההישנות בחולה עם פ”פ לסרוגין, שאינו מקבל טיפול נגד הפרעות קצב מגיע ל-75% בשנה. מתן טיפול תרופתי נגד הפרעות קצב מאפשר שמירת קצב סינוס ב-50% עד 70% מן החולים. התרופה היעילה ביותר בשמירת קצב סינוס היא – amiodarone המוכרת בשם פרוקור. למרות יעילותה בשמירת קצב סינוס התרופה עתירה בתופעות לוואי שחלקם מסוכנות ביותר. תרופות כגון propafenone – ריתמקס, flecainide טמבוקור או – sotalol סוטלול נמצאו פחות יעילות. חשוב ביותר לבחור ולהתאים את התרופה נגד הפרעות קצב לכל חולה לפי מצבו הכללי, ומחלת הלב שלו. לתרופות נגד הפרעות קצב ישנן תופעות לוואי רבות כולל גרימת הפרעות קצב אחרות ומסוכנות יותר מן ההפרעה המקורי. אפקט הנקרא פרו-אריתמי. כלומר למרבית התרופות השפעה מוגבלת למניעת הפרעות קצב עם פוטנציאל להחמרה של הפרעות הקצב במידה ולא נעשית הבחירה והשילוב התרופתי הנכון.

לאחר שנים רבות בהן לא פותחו תרופות חדשות נגד הפרעות קצב, פותחה לאחרונה ואושרה כבר לשימוש בארה”ב ע”י ה FDA התרופה dronedarone (תמונה מס 6) אשר שמה המסחרי הוא מולטק-.MULTAQ התרופה דומה במבנה המולקולרי שלה ל amiodarone – פרוקור, אשר נחשבת לתרופה היעילה ביותר נגד פ”פ (עם תופעות לוואי רבות). ה MULTAQ אינה מכילה את מולקולת היוד הנמצאת בכמות גדולה ב amiodarone ואחראית לתופעות הלוואי הרבות של תרופה זו. MULTAQ הינה התרופה לטיפול בהפרעות קצב שנבדקה במספר רב של מחקרים על מספר החולים הגדול ביותר שנבדק אי פעם במחקרי תרופות נגד הפרעות קצב, מעל 4000 חולים. במחקרים אלו נמצא כי התרופה בטוחה מאוד ושיעור תופעות הלוואי שלה נמוך ביותר. לדוגמא במחקר ATHENA המחקר הגדול ביותר אשר נערך על תרופה נגד הפרעת קצב, MULTAQ הביאה להורדת תמותה, אישפוזים ואירועים מוחיים בהשוואה לחולים שטופלו בפלצבו. התרופה מורידה שיעור של אירועים כליליים בחולים המטופלים בה וכן יש לה גם אפקט של בקרת קצב האטת קצב הלב זמן שהחולה נמצא ב פ”פ. בשל מאפייני התרופה, הליך האישור שלה בארה”ב ע”י ה FDA היה מהיר. יעילותה במניעת הישנות פרפור פרוזדורים נמוכה מ amiodarone כמו כן פרופיל הבטיחות שלה עולה אין שיעור על amiodarone. כלומר בידינו תרופה לשמירת קצב סינוס עם פרופיל בטיחות מצוין. התרופה נמצאת בהליך אישור לשימוש בישראל.
הקבוצה היחידה שלא מומלץ להשתמש בה בתרופה זו הינה חולים באי ספיקת לב דרגה תפקודית לפי NYHA של III – IV .
טיפולים לא תרופתיים לשמירת קצב סינוס:
אבלציה באמצעות צנתר לריפוי פ”פ תופסת מקום חשוב בטיפול בחולים עם אירועים חוזרים של פ”פ וכישלון טיפול תרופתי. טיפול זה, שהוא ממושך ופולשני, מיועד בשלב זה לחולים צעירים יחסית, ללא מחלות רקע מורכבות. ובעיקר בחולים עם פ”פ התקפי. שיעור ההצלחות בריפוי פ”פ בשיטה זו הוא בין 60% ל-90% בסדרות שונות ושיעור סיבוכים משמעותיים המגיע עד 5% . היתרון הגדול של שיטה זו גלום בעובדה שניתן להציע לחלק מן החולים ריפוי של מחלה כרונית, הפסקת טיפול התרופתי נגד הפרעות וטיפול נוגד קרישה טיפול אשר הינו פריצת דרך בטיפול ב פ”פ.
ניתן לבצע אבלציה גם בעת טיפול ניתוחי במהלך ניתוח לב למטרה אחרת כגון החלפת או תיקון מסתם מיטראלי או לשלב ניתוח זעיר פולשני עם אבלציה מלעורית .
העדויות המדעיות המצטברות מעידות על שיפור משמעותי באיכות ותוחלת החיים בחולים שעברו אבלציה מוצלחת לעומת טיפול תרופתי. כיום מקובל להפנות חולים לטיפול זה לאחר כישלון של טיפול תרופתי נגד הפרעות קצב.
השתלת קוצב אינה טיפול בפ”פ. לעיתים השתלת קוצב בחולה עם פ”פ לסירוגין מאפשרת טיפול טוב יותר בתרופות נגד הפרעות קצב ומניעת דופק איטי אשר הינו תופעת לוואי של חלק מן הטיפולים התרופתיים.
טיפולים במעלה הזרם – Upstream. הטיפולים בפ”פ עוסקים בתופעות המחלה. בשנים האחרונות מתברר כי יש צורך במניעת המחלה או בטיפול בהיווצרות המחלה. ניתן להשיג זאת ע”י הגנה לפרוזדורים מפני תהליכים דלקתיים, שינויים תאיים, השפעות הורמונאליות, הפרעות שינה, משקל עודף ויתר לחץ דם. משום כך מוצעים לשימוש טיפולים נוספים למניעת פ”פ כמו: סטטינים המוכרים כטיפולים להורדת קולסטרול, אומגה 3, הורדת משקל, טיפול בהפרעות שינה ועוד. יחד עם זאת יש לציין שהעדויות המדעיות ליעילות טיפולים אלו חלקיות.
הגישה הכוללנית לחולה עם פרפור פרוזדורים הטיפול הנכון בחולה עם פ”פ מבוסס על תוצאות המידע המחקרי שנצבר בנושא במשך השנים, תוך התאמה אישית של הטיפול לכל חולה בהתאם לסימפטומים, לגיל, למצב הלב ולמחלות הרקע. טיפול מושכל בחולה עם פ”פ יקל עליו ויפחית סיבוכים, תחלואה ותמותה.
האור בקצה המנהרהההבנה של מנגנוני הפרעת הקצב, עדכון הגישה והסיכוי לריפוי המחלה הינם האור בקצה המנהרה.
החידושים הינם בתחום מניעת תסחיפים. תרופות נוגדות קרישה חדשות וקלות לשימוש יעמדו לרשות החולים והמטפלים בעתיד הקרוב וכן שימוש באמצעי לחסום את אוזנית ההשמאלי השמאלית.
בתחום בקרת מקצב הלב Rhythm control תתוסף בעתיד הקרוב בארץ ה MULTAQ תרופה לטיפול בהפרעות קצב חדשה עם שיעור תופעות לוואי נמוך. במקביל חל שיפור שיטות האבלציה לריפוי פ”פ המביא לשיפור בהצלחת הפעולה והפחתת שיעור הסיבוכים
References














השאירו תגובה
רוצה להצטרף לדיון?תרגישו חופשי לתרום!